

|
Les enfants d'Orion |
|
La matière a ceci d'exceptionnel , c'est de pouvoir émettre ou absorber de l'énergie sous forme de lumière. Or, pour étudier une étoile, nous ne disposons que de sa lumière. Toutes les connaissances que nous avons des étoiles nous viennent de l'analyse de la lumière qu'elles émettent . Cette analyse s'appelle la spectroscopie : science fondamentale en astronomie. Après avoir présenté les différents spectres observables et la façon de les obtenir, nous avons essayé de les expliquer simplement , en prenant, pour l'atome , le modèle de Bohr. Il nous permet d'interpréter les phénomènes d'absorption et d'émission de lumière correspondant aux observations spectrales. Une troisième partie développe les applications de la spectroscopie à l'astrophysique : couleur des nébuleuses, couleur et température des étoiles, composition de leur atmosphère, détermination de leur taille , effet Doppler-Fizeau. |
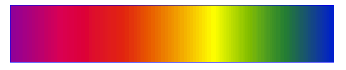

| Un spectre d'émission dépend de la température de la source. Plus la source est chaude , plus il est étendu vers le bleu. Un gaz à pression élevée, un liquide ou un solide, portés à haute température, émettent un spectre continu. |






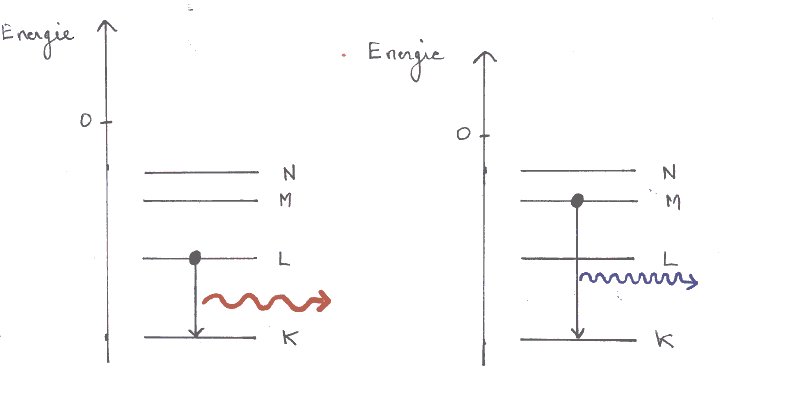
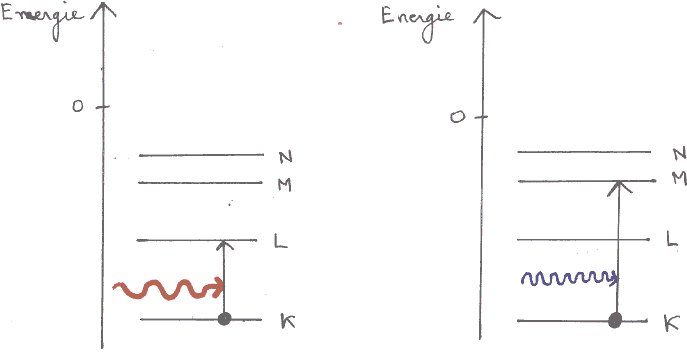

|
La spectroscopie, puissant moyen d'investigation, a fait avancer de façon spectaculaire la recherche en astronomie, notamment dans la connaissance des étoiles. Elle a permis, entre autres découvertes : l'identification d'éléments chimiques dans leur atmosphère, l'évaluation de leur température externe, la mise en évidence de l'élément hydrogène dans les vastes nuages de gaz et de poussières interstellaires. |
retour à la page d'accueil
Nous contacter : 
mise à jour 17 juillet 2005